一、实验目的
臭氧是氧的同素异构体,具有很强的氧化性,不仅能容易的氧化废水中的不饱和有机物,而且还能使芳香族化合物开环和部分氧化,提高废水的可生化性。臭氧极不稳定,在常温下分解为氧。用臭氧处理废水的最大优点是不产生二次污染,且能增加水中的溶解氧,臭氧通常用于水体的消毒,在废水脱色及深度处理中也渐获得应用。在工业上,一般采用无声放电制取臭氧,原料为空气,廉价易得。因此利用臭氧处理水和废水具有广阔的前景。通过本实验希望达到以下目的:
1.了解特性,掌握臭氧浓度测定方法;
2.通过对染色废水的处理,了解臭氧处理工业废水的基本过程。
二、实验仪器及设备
实验仪器:臭氧发生器,洗气瓶,碱式滴定管,量筒,锥形瓶,pH试纸,分光光度计,大烧杯;
实验试剂:2%的KI溶液,醋酸,0.005mol/L的Na2S2O3 ,1%淀粉溶液,蒸馏水,分散蓝溶液
三、实验原理
臭氧是一种强氧化剂,它的氧化能力在天然元素中仅次于氟。臭氧在污水处理中可用于除臭、脱色、杀菌、消毒、降酚、降解COD、BOD等有机物。
臭氧在水溶液中的强烈氧化作用,不是O3本身引起的,而主要是由臭氧在水中分解的中间产物·OH基及HO2基引起的。很多有机物都容易与臭氧发生反应。例如臭氧对水溶性染料、蛋白质、氨基酸、有机氨及不饱和化合物、酚和芳香族衍生物以及杂环化合物、木质素、腐殖质等有机物有强烈的氧化降解作用;还有强烈的杀菌、消毒作用。
臭氧氧化的优点:
1.臭氧能氧化其它化学氧化,生物氧化不易处理的污染物,对除臭、脱色、杀菌、降解有机物和无机物都有显著效果;
2.污水经处理后污水中剩余的臭氧易分解,不产生二次污染,且能增加水中的溶解氧;
3.制备臭氧利用空气作原料,操作简便。
工业上采用高压(1.5—3万伏)高频放电制取臭氧,通常制得的是含1—4%臭氧的混合气体,称为臭氧化气体。
1.臭氧氧化有机物的机理:
1)直接反应机理—臭氧分子直接进攻有机物的反应
(1)打开双键,发生加成反应:借助其偶极结构同有机物的不饱和键发生加成反应,形成臭氧化中间产物,并进一步分解。
R1C=CR2+O3 → R1GCOOH+R2C=O G代表-OH、-OCH3、-OCOCH3
(2)亲电反应
(3)亲核反应
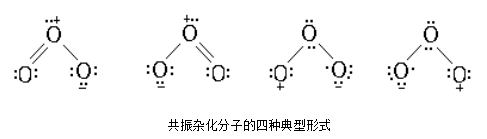
臭氧分子的共振三角形结构表明,它可以作为偶极试剂、亲电试剂和亲核试剂,与有机物形成三类反应。
2)间接反应机理—臭氧分解形成自由基与有机物的反应
溶解性臭氧分解形成羟基自由基,HO·通过不同的反应使溶解态无机物和有机物氧化。
链引发-传递-终止
(1)溶解性臭氧的分解机理
HSB (Hoigne, Staehelin和Bader) 机理
GTF (Gorkon, Tomiyasn和Futomi) 机理
(2)HO·与溶解态化合物间的反应
电子转移反应——从其它物质上抽取电子, 自身还原为OH-;
抽氢反应 ——从有机物的不同取代基上抽取H使有机物变为有机物自由基, 自身则转变为H2O;
OH·加成反应 — OH·加成到烯烃或芳香碳氢化合物双键上.
臭氧脱色的机理是臭氧及其产生的活泼自由基OH·使染料发色基团中的不饱和键(芳香基或共轭双键)断裂生成小分子量的酸和醛,生成了低分子量的有机物,从而导致水体色度显著降低。臭氧对亲水性染料的脱色速度快,效果好;对疏水性染料的脱色速度慢,效果差,且需臭氧量大。臭氧可氧化铁、锰等无机有色离子为难溶物臭氧的微絮凝效应还有助于有机胶体和颗粒物的混凝,并通过过滤去除致色物。
2.臭氧氧化性能的影响因素--溶液pH
pH的变化将改变臭氧氧化反应的作用机理和去除效果
1)臭氧本身的氧化能力与pH 值有关
臭氧在水中的分解速度随着pH 值的提高而加快 ,在pH<4时,臭氧在水溶液中的分解可以忽略不计,其反应主要时溶解臭氧分子同被处理水溶液中还原性物质的直接反应;在pH>4时,臭氧的分解便不可忽略,在pH更高时,则臭氧主要是在OH的催化作用下,经一系列链式反应分解成具有高反应活性的自由基而对还原性物质进行非选择性氧化降解。 如果pH值提高一个单位臭氧分解大约快3倍。
2)污水中有机物或无机物的物理化学性质与pH值有密切关系
3)臭氧吸收率与pH值有一定关系
pH 值在整个臭氧氧化过程中的变化,主要是在中性或碱性条件下pH值会随着氧化过程而呈下降趋势,其原因是有机物氧化成小分子有机酸或醛之类物质。碱性条件下的污染物去除率高于酸性条件
3.臭氧氧化性能的影响因素--溶液温度
提高反应溶液温度将使反应的活化能降低,有利于提高化学反应速率。但是,随温度的升高,臭氧其分解将加速,溶解度降低,从而降低了液相中臭氧的浓度,减缓化学反应速度。同时,由于臭氧氧化有机物的反应是一个连串反应,在降解有机物的同时也要对其氧化中间产物进行深度氧化,消耗液相中的臭氧,减缓目标有机物的降解速率。为与工业实际废水相接近,实验选择温度范围为3~30度。
4.臭氧氧化性能的影响因素--催化剂
碱催化臭氧氧化:如O3/H2O2,它们是通过OH-来催化产生·OH而对有机物进行降解;光催化臭氧氧化:如O3/UV、O3/H2O2/UV;多相催化臭氧氧化:如O3/固体催化剂(如活性炭、金属及其氧化物)。
5.臭氧技术在应用中存在的问题
低浓度臭氧处理有机物时不能将其完全氧化为二氧化碳和水,而是生成一系列中间产物,如醛、羧酸等;臭氧溶解度低,限制了臭氧在水处理中的应用。臭氧生产中对进入发生器的空气质量要求高,且臭氧有腐蚀性,要求设备和管路使用耐腐蚀材料或作防腐处理;臭氧极不稳定 重量浓度为1%以下的臭氧在常温(常压)的空气中的半衰期为16小时,水中臭氧浓度为3 mg/L时,半衰期仅30分钟左右。
实验原理思考题:
1.废水经臭氧反应后,CODcr是否会升高,为什么?
答:可能会升高。
1)臭氧的作用有分解大分子基团,把一些原本无法检测的物质变成显性的。所以如果在作用的初期即臭氧投加量较小的时候,或是臭氧在臭氧接触池内传质效率低,或是停留时间不足,都有可能影响到COD的降解效果,使得原来比较稳定难降解大分子物质(不显COD)变成易降解的小分子物质(显COD)。这样就会出现CODcr升高的情况。
2)实验设备引起,如:乳胶管插在水中就可被氧化使的CODcr升高。
四、实验步骤
1.O3浓度的测定:
用量筒取250ml 的2%的KI溶液加入气体吸收瓶,然后通入O3 90s,取100ml反应液于锥形瓶中,用醋酸酸化至pH=4,用0.005mol/L的Na2S2O3滴至淡黄色,加入1%淀粉溶液,继续滴定至无色,记录滴定消耗Na2S2O3的体积。
2.臭氧脱色效率的测定:
(1)取两个气体吸收瓶,分别装入250ml直接蓝溶液和2%的KI溶液,用胶管连接通O3 45s。
(2)取分散蓝溶液反应液在最大吸收波长580nm下测吸光度,计算O3的溢出量,求O3的脱色效率和吸收率。
(3) 取反应后KI溶液100ml于锥形瓶中,用醋酸酸化至pH=4,用0.005mol/L的Na2S2O3滴至淡黄色,加入1%淀粉溶液,继续滴定至无色,记录滴定消耗Na2S2O3的体积。
(4)调解原水的pH为3和10,重复(1)(2)(3)。
测定臭氧在水中的浓度,采用碘量法
臭氧先用KI溶液吸收,生成I2用Na2S2O3标准溶液滴定
O3+2KI+H2O===O2+I2+2KOH
I2+2Na2S2O3===Na2S4O6+2NaI
测定方法:
1、臭氧吸收:取250mL 2%KI溶液于吸收瓶中,通入臭氧化气1.5min。
2、取吸收臭氧的KI溶液(2%)溶液100ml于锥形瓶中,用冰醋酸酸化调pH=4用0.005mol/LNa2S2O3标准溶液滴定至淡黄色时,再加入1%淀粉指示剂,此时溶液为蓝色,再迅速滴定至蓝色消失为终点。
注意:对于不同pH值得有色溶液,要注意溶液臭氧吸收量与脱色率之间的联系。
五、实验原始数据
1.通入O390s后的 2%的KI溶液用0.005mol/L的Na2S2O3溶液滴定,消耗Na2S2O3溶液体积=56.5mL
2.不同pH的原水吸收臭氧后用0.005mol/L的Na2S2O3溶液滴定。
| 水样 | 滴定消耗Na2S2O3(mL) | 吸光度Abs | | 原水 |
| 0.538 | | pH=3 | 24.7 | 0.353 | | pH=7 | 24.6 | 0.297 | | pH=10 | 20.5 | 0.455 |

六、数据处理及结论


七、思考题
为加强某染色废水的处理效果,有人想将臭氧氧化和活性碳吸附联用,他的想法可行吗?为什么?
答:可行。
单纯臭氧对高稳定性有机污染物的氧化能力有限。由于在富氧的条件下活性炭表面形成了生物膜,水中的有机物容易在生物膜上分解,此时活性碳变成了生物活性碳,对有机物产生吸附和生物分解的双重作用,使活性碳的吸附能力得到增强。所以臭氧氧化与活性碳吸附联用系统可以提高对水中有机污染物的去除效果,提高有机物的可生化性,延长活性碳的使用周期,对染色废水的色度去除率有较大提高。
|



